Головна
Каталог ліків
Медикаменти
Кровоносна система
Кровоспинні препарати
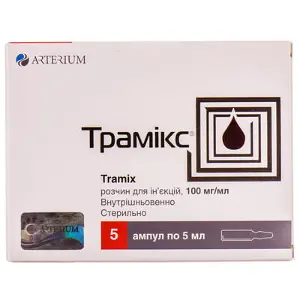
ТРАМІКС
Трамікс розчин для ін'єкцій в ампулах по 5 мл, 100 мг/мл, 5 шт.
Трамікс розчин для ін'єкцій в ампулах по 5 мл, 100 мг/мл, 5 шт.
Дата оновлення препарату: 10.03.2024
Ціни у місті
Знайдено в аптеках:
від 348.50 ₴ до 354.90 ₴
Характеристики
Категорія
Дозування
100 мг/мл
Виробник
ПАТ «Галичфарм»
Країна-виробник
Україна
Торгова назва
Форма випуску
Розчин для ін'єкцій
Термін придатності
2 роки
Активні речовини
Транексамова кислота
Кількість в упаковці
5
Спосіб введення
внутрівенно
Код Моріон
310524
Код АТС/ATX
B02A A02
Кому можна
АЛЕРГІКАМ
з обережністю
ДІАБЕТИКАМ
з обережністю
ДІТЯМ
Дозволено
Особливості
РЕЦЕПТУРНИЙ ВІДПУСК
без рецепту
ТЕМПЕРАТУРА ЗБЕРІГАННЯ
від 5°C до 25°C
Зверніть увагу!
Інструкція, розміщена на цій сторінці, має інформаційний характер та призначена виключно для ознайомлення. Не використовуйте цю інструкцію в якості медичних рекомендацій. Постановлення діагнозу та вибору методики лікування здійснюються тільки вашим сімейним лікарем. Медмаркет LikiE не несе відповідальності за можливі негативні наслідки, виникщі в результати використання інформації, розміщеної на сайті likie.ua.
Детальіше про Відмова від відповідальності.
Інструкція для Трамікс розчин для ін'єкцій в ампулах по 5 мл, 100 мг/мл, 5 шт.
Важливо! Ця інструкція із застосування є офіційною інструкцією виробника, затвердженою та наданою Державним реєстром лікарських засобів України. Ця інструкція представлена винятково з метою ознайомлення і не є підставою для самолікування.
По 5 мл у ампулі, по 5 ампул у контурній чарунковій упаковці; по 1 контурній чарунковій упаковці у пачці.
Розчин для ін’єкцій.
Основні фізико-хімічні властивості: прозора безбарвна рідина.Транексамова кислота чинить антигеморагічну дію шляхом пригнічення фібринолітичних властивостей плазміну.
З участю транексамової кислоти та плазміногену утворюється комплекс; транексамова кислота зв’язується з плазміногеном при перетворенні на плазмін.
Активність комплексу транексамової кислоти-плазміну щодо фібрину нижча порівняно з активністю вільного плазміну.
Високі дози транексамової кислоти знижували активність комплементу.
Діти віком від 1 року. Є дані про зменшення крововтрати і зниження потреби у продуктах крові в дитячій кардіохірургії зі штучним кровообігом, де є високий ризик виникнення кровотечі, особливо у ціанотичних пацієнтів або пацієнтів, які проходять повторне хірургічне втручання. Виявлено, що найадаптованішим є такий режим дозування:
перше болюсне введення 10 мг/кг після початку наркозу і перед розрізом шкіри;
безперервна інфузія 10 мг/кг/год або ін’єкція у рідину для наповнення апарату штучного кровообігу у дозі, що відповідає процедурі штучного кровообігу або відповідно до маси тіла пацієнта у дозі 10 мг/кг, або відповідно до об’єму наповнення апарату штучного кровообігу, остання ін’єкція – 10 мг/кг наприкінці процедури штучного кровообігу.
Обмежені дані дозволяють припустити, що безперервне введення є найбільш прийнятним, оскільки воно підтримує терапевтичну концентрацію у плазмі крові протягом усього періоду оперативного втручання.
У дітей не проводили ніяких специфічних дозозалежних досліджень.Всмоктування. Максимальна концентрація транексамової кислоти у плазмі крові швидко досягається після короткого внутрішньовенного введення, після чого знижується мультиекспоненційним чином.
Розподіл. Білок плазми зв’язує близько 3 % від терапевтичного плазмового рівня транексамової кислоти, і це зумовлено ймовірно його зв’язуванням із плазміногеном. Транексамова кислота не зв’язується з альбуміном сироватки крові. Початковий об’єм розподілу становить близько 9-12 літрів.
Транексамова кислота проходить крізь плацентарний бар’єр. Після введення внутрішньовенно у дозі 10 мг/кг вагітним жінкам концентрація транексамової кислоти у сироватці крові коливалася у діапазоні 10-53 мкг/мл, у пуповинній крові – у діапазоні 4-31 мкг/мл. Транексамова кислота швидко проникає у синовіальну рідину та синовіальну оболонку. Після введення внутрішньовенно у дозі 10 мг/кг пацієнтам, які перенесли операцію на коліні, концентрація у синовіальній рідині була подібною до концентрації, що спостерігалася у відповідних зразках сироватки крові. Концентрація транексамової кислоти в інших тканинах становила таку частку щодо концентрації у крові: у грудному молоці – близько 1/100, у цереброспінальній рідині – близько 1/10, у внутрішньоочній рідині – близько 1/10. Транексамова кислота була виявлена у сім’яній рідині, де вона інгібує фібринолітичну активність, але не впливає на міграцію сперматозоїдів.
Виведення. Виводиться переважно із сечею у незміненому вигляді. Виведення із сечею шляхом клубочкової фільтрації є основним шляхом виведення. Нирковий кліренс дорівнює кліренсу плазми (110-116 мл/хв). Виведення транексамової кислоти становить близько 90 % протягом перших 24 годин після внутрішньовенного введення у дозі 10 мг/кг маси тіла. Період напіввиведення транексамової кислоти становить приблизно 3 години.
Особливі групи. Концентрація у плазмі збільшується у пацієнтів із нирковою недостатністю.
Окремих досліджень фармакокінетики у дітей не проводили.Антигеморагічні засоби. Інгібітори фібринолізу. Амінокислоти. Код АТХ B02A A02.
Дослідження взаємодії лікарських засобів не проводили. Паралельний (одночасний) прийом антикоагулянтів повинен відбуватися під суворим наглядом лікаря, який має досвід у цьому напрямку терапії. Лікарські препарати, що діють на гемостаз, слід застосовувати з обережністю пацієнтам, які отримали лікування із застосуванням транексамової кислоти. У цих випадках існує ризик тромбоутворення, наприклад при застосуванні естрогенів. Крім того, антифібринолітична дія препарату може бути антагонізована при застосуванні тромболітиків.
діюча речовина: транексамова кислота;
1 мл розчину містить транексамової кислоти, в перерахунку на 100 % речовину – 100,0 мг;
допоміжна речовина: вода для ін’єкцій.Дослідження з оцінки впливу на здатність керувати автотранспортом або іншими механізмами відсутні.
Жінки репродуктивного віку під час лікування повинні використовувати ефективні засоби контрацепції.
Клінічних даних щодо застосування транексамової кислоти вагітним жінкам недостатньо.
Протягом І триместру вагітності в якості запобіжного заходу призначення транексамової кислоти не рекомендується.
Є тільки обмежені клінічні дані щодо застосування транексамової кислоти при різних клінічних геморагічних станах під час ІІ і ІІІ триместру вагітності, за якими неможливо ідентифікувати шкідливий вплив на плід. Транексамову кислоту застосовувати у період вагітності можливо тільки у тому випадку, якщо очікувана терапевтична користь виправдовує потенційний ризик.
Транексамова кислота проникає у материнське молоко. Таким чином, грудне годування не рекомендується.
Відсутні клінічні дані про вплив транексамової кислоти на фертильність.Дітям віком від 1 року застосовувати у дозі 20 мг/кг/добу. Дані з ефективності, дозування та безпеки є обмеженими.
Ефективність, дозування і безпека транексамової кислоти у дітей, які перенесли операцію на серці, повністю не встановлені.Кровотеча або ризик кровотечі при посиленні фібринолізу, як генералізованого, так і місцевого, у дорослих і дітей віком від 1 року.
Специфічні показання включають кровотечі, зумовлені підвищеним загальним або місцевим фібринолізом, такі як:
менорагія і метрорагія;
шлунково-кишкові кровотечі;
геморагічні розлади сечовивідного тракту, що виникли у зв’язку з хірургічним втручанням на передміхуровій залозі або внаслідок оперативного втручання чи процедур на сечовивідних шляхах;
отоларингологічні (видалення аденоїдів, тонзилектомія) та стоматологічні (видалення зубів) оперативні втручання;
гінекологічні операції або ускладнення в акушерській практиці;
горакальні, абдомінальні та інші великі хірургічні оперативні втручання, наприклад серцево-судинна хірургія;
контроль крововиливів у зв'язку з введенням фібринолітичного лікарського засобу.Підвищена чутливість до активної речовини або будь-якого з компонентів препарату;
гострий венозний або артеріальний тромбоз;
фібринолітичні стани з гострою тяжкою кровотечею через введення коагулопатичних засобів (антикоагулянтів), за винятком тих препаратів, які переважно здійснюють активацію фібринолітичної системи;
тяжка ниркова недостатність (існує ризик накопичення лікарського засобу);
судоми в анамнезі;
інтратекальне і внутрішньошлуночкове ін’єкційне введення, інтрацеребральне введення (ризик набряку мозку з подальшим розвитком судом).Трамікс® вводити тільки внутрішньовенно (краплинно, струминно).
При генералізованому фібринолізі вводити у дозі 1 г (2 ампули по 5 мл) або 15 мг/кг маси тіла кожні 6-8 годин внутрішньовенно повільно (швидкість введення – 1 мл/хв).
При місцевому фібринолізі рекомендується застосовувати препарат у дозі від 0,5 г (1 ампула по 5 мл) до 1 г (2 ампули по 5 мл) 2-3 рази на добу внутрішньовенно повільно (швидкість введення – 1 мл/хв).
Порушення функції нирок
У випадку ниркової недостатності існує ризик акумуляції, тому застосування транексамової кислоти пацієнтам із важкою нирковою недостатністю протипоказано.
Для пацієнтів із легкою та середньою формою ниркової недостатності дозування підбирається відповідно до рівня креатиніну в сироватці крові.
Креатинін сироватки Внутрішньо-венна доза Введення
мкмоль/л мг/10 мл
120-249 1,35-2,82 10 мг/кг маси тіла кожні 12 годин
250-500 2,82-5,65 10 мг/кг маси тіла кожні 24 години
>500 >5,65 5 мг/кг маси тіла кожні 24 години
Порушення функції печінки
При захворюваннях печінки корекція дози не потрібна.
Пацієнти літнього віку не потребують корекції дози у випадку відсутності ниркової недостатності.
Трамікс® можна змішувати з розчинами електролітів, амінокислот та розчином глюкози.
У розчин для ін’єкцій можна додавати гепарин.
Готувати розчин необхідно перед самим введенням. Невикористаний розчин слід утилізувати.Нижче зазначені побічні реакції, систематизовані відповідно до класифікатора MedDRA (основні класи систем органів). У межах кожного класу систем органів побічні реакції упорядковані за частотою. У кожній групі за частотою побічні реакції представлено в порядку зменшення проявів. Частоту було визначено таким чином: дуже часто (> 1/10); часто (> 1/100 до < 1/10); нечасто (> 1/1000 до < 1/100), невідомо (не можна оцінити за наявними даними).
З боку шкіри та підшкірної тканини
Нечасто: алергічні дерматити.
З боку травної системи
Часто: діарея, блювання, нудота.
З боку нервової системи
Невідомо: судоми, зокрема у разі неправильного застосування.
З боку органів зору
Невідомо: порушення зору, включаючи порушення кольорового сприйняття.
З боку системи крові та лімфатичної системи
Невідомо: нездужання, спричинене гіпотонією, з втратою свідомості або без (як правило, після занадто швидкої внутрішньовенної ін’єкції, як виняток – після перорального прийому).
Артеріальна або венозна тромбоемболія на будь-яких ділянках.
З боку імунної системи
Невідомо: реакції гіперчутливості, включаючи реакції анафілактичного типу.Випадки передозування не спостерігалися.
Симптоми передозування можуть включати запаморочення, головний біль, гіпотензію і судоми (конвульсії). Частота виникнення судом зростає зі збільшенням дози.
Лікування передозування симптоматичне.Зберігати в оригінальній упаковці при температурі не вище 25 °С. Не заморожувати!
Зберігати у недоступному для дітей місці.
Несумісність
Цей лікарський засіб не слід додавати до крові для переливання або до ін’єкційних розчинів пеніциліну.Препарат призначений для пацієнтів з кровотечею або ризиком кровотечі при посиленні фібринолізу, як генералізованого, так і місцевого, у дорослих та дітей старше 1 року.
Часті запитання
- Ціна на препарат Трамікс розчин для ін'єкцій в ампулах по 5 мл, 100 мг/мл, 5 шт. в Україні від 348.5 до 354.9
- Діючі речовини у Трамікс розчин для ін'єкцій в ампулах по 5 мл, 100 мг/мл, 5 шт. є Транексамова кислота
- Трамікс розчин для ін'єкцій в ампулах по 5 мл, 100 мг/мл, 5 шт. є безрецептурним препаратом, та відпускається без рецепту
- Трамікс розчин для ін'єкцій в ампулах по 5 мл, 100 мг/мл, 5 шт. приймати перед керуванням транспорту
- Трамікс розчин для ін'єкцій в ампулах по 5 мл, 100 мг/мл, 5 шт. приймати вагітним
- Трамікс розчин для ін'єкцій в ампулах по 5 мл, 100 мг/мл, 5 шт. приймати під час грудного вигодовування
- Трамікс розчин для ін'єкцій в ампулах по 5 мл, 100 мг/мл, 5 шт. з обережністю приймати алергетикам
- Трамікс розчин для ін'єкцій в ампулах по 5 мл, 100 мг/мл, 5 шт. з обережністю приймати діабетикам
- Рекомендована температура для зберігання Трамікс розчин для ін'єкцій в ампулах по 5 мл, 100 мг/мл, 5 шт. від 5°C до 25°C
- Рекомендований термін зберігання Трамікс розчин для ін'єкцій в ампулах по 5 мл, 100 мг/мл, 5 шт. 2 роки
Відгуки про товар
Ще немає відгуків про товар.Будь першим, хто залишить відгук.