Головна
Каталог ліків
Медикаменти
Препарати від алергії
Від алергічного риніту
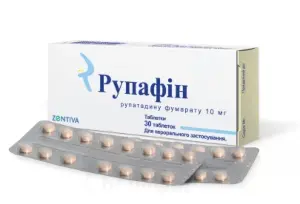
Рупафін таблетки по 10 мг, 30 шт.
Рупафін таблетки по 10 мг, 30 шт.
Дата оновлення препарату: 25.09.2025
Ціни у місті
Знайдено в аптеках:
від 410.90 ₴ до 531.90 ₴
Характеристики
Категорія
Дозування
10 мг
Виробник
НОУКОР ХЕЛС, С.А.
Країна-виробник
Іспанія
Форма випуску
таблетки
Термін придатності
3 роки
Активні речовини
рупатадину фумарат
Кількість в упаковці
30
Спосіб введення
орально
Код АТС/ATX
R06AX28
Кому можна
АЛЕРГІКАМ
з обережністю
ДІАБЕТИКАМ
дозволено
Вагітним
заборонено
ГОДУЮЧИМ МАТЕРЯМ
з обережністю
ДІТЯМ
з 12 років
Особливості
РЕЦЕПТУРНИЙ ВІДПУСК
тільки з рецептом від лікаря
ТЕМПЕРАТУРА ЗБЕРІГАННЯ
від 5 °С до 25 °С
Зверніть увагу!
Інструкція, розміщена на цій сторінці, має інформаційний характер та призначена виключно для ознайомлення. Не використовуйте цю інструкцію в якості медичних рекомендацій. Постановлення діагнозу та вибору методики лікування здійснюються тільки вашим сімейним лікарем. Медмаркет LikiE не несе відповідальності за можливі негативні наслідки, виникщі в результати використання інформації, розміщеної на сайті likie.ua.
Детальіше про Відмова від відповідальності.
Інструкція для Рупафін таблетки по 10 мг, 30 шт.
Важливо! Ця інструкція із застосування є офіційною інструкцією виробника, затвердженою та наданою Державним реєстром лікарських засобів України. Ця інструкція представлена винятково з метою ознайомлення і не є підставою для самолікування.
- По 15 таблеток у блістері, по 2 блістера у картонній коробці.
- Таблетки. Основні фізико-хімічні властивості: круглі таблетки, світлого рожево-помаранчевого кольору, без маркування.
- Рупатадин належить до другого покоління антигістамінних препаратів і є антагоністом гістаміну тривалої дії з вибірковою периферичною антагоністичною активністю до Н1-рецепторів. Деякі з його метаболітів (дезлоратадин і його гідроксильовані метаболіти) зберігають антигістамінну активність і можуть частково робити свій внесок до загальної ефективності препарату. Дослідження рупатадину in vitro у високій концентрації показали гальмування дегрануляції опасистих клітин, спричинене імунологічними і неімунологічними подразниками, а також вихід цитокінів, зокрема TNFa, із опасистих клітин і моноцитів людини. Клінічне значення спостережуваних експериментальних даних ще тільки належить підтвердити. Під час клінічних досліджень застосування рупатадину у дозі від 2 мг до 100 мг у добровольців (n=375) та пацієнтів (n=2650) з алергічним ринітом та хронічною ідіопатичною кропив’янкою не було виявлено значного впливу препарату на результати електрокардіографічного дослідження. Хронічна ідіопатична кропив’янка досліджувалась в умовах клінічної моделі захворювання, оскільки, незважаючи на етіологію, патофізіологія захворювання залишається такою ж, а також тому що в перспективі пацієнтів із хронічною формою буде легше залучити до участі у дослідженні. Через те що вивільнення гістаміну є причинним фактором усіх проявів кропивʼянки, очікується ефективність рупатадину при проведенні симптоматичної терапії хронічної ідіопатичної кропивʼянки та інших проявів кропивʼянки, як це вказано у клінічних настановах. Під час плацебо-контрольованих досліджень хронічної ідіопатичної кропив’янки рупатадин ефективно знижував середній бал симптомів (зниження порівняно із початковими показниками: рупатадин – 57,5 %, плацебо – 44,8 %) та середню кількість висипань (54,3 % порівняно з 39,7 %) через чотири тижні лікування.
- Абсорбція і біологічна доступність. Рупатадин швидко всмоктується після перорального прийому, tmax становить приблизно 0,75 години після прийому таблетки. Середня Сmax становила 2,6 нг/мл після одноразового прийому пероральної дози 10 мг і 4,6 нг/мл після одноразового перорального прийому дози 20 мг. Фармакокінетика рупатадину була лінійною для доз від 10 до 40 мг. Після прийому дози 10 мг один раз на добу протягом 7 днів середня Сmax становила 3,8 нг/мл. Концентрація в плазмі знижувалася за біекспоненціальною кривою з середнім періодом напіввиведення 5,9 години. Коефіцієнт звʼязування рупатадину з білками плазми становив 98,5–99 %. Оскільки рупатадин ніколи не призначався людям внутрішньовенно, даних про його абсолютну біологічну доступність немає. Ефект прийому їжі Прийом їжі підсилює загальну дію рупатадину на організм (AUC, площа під кривою концентрація–час) приблизно на 23 %. Дія на один з його активних метаболітів і на основний неактивний метаболіт була практично однаковою (зниження приблизно на 5 % і на 3 % відповідно). Час, необхідний для досягнення максимальної концентрації рупатадину в плазмі крові (tmax), подовжувався на 1 годину. Максимальна концентрація в плазмі (Сmax) в результаті прийому їжі не змінювалася. Ці відмінності не мали клінічного значення. Метаболізм і виведення Протягом 7-денного дослідження екскреції у людини (40 мг 14С-рупатадину) було виявлено, що 34,6 % введеної з препаратом радіоактивності виводилося з сечею, а 60,9 % – з фекаліями. Рупатадин піддається значному пресистемному метаболізму при пероральному застосуванні. Незмінена активна субстанція виявлялася в сечі і фекаліях лише в незначній кількості. Це означає, що рупатадин майже повністю метаболізується. Активний метаболіт дезлоратадин та інші гідроксильовані похідні досягали відповідно приблизно 27 % та 48 % від загальної системної експозиції діючої речовини. Дослідження метаболізму in vitro в мікросомах печінки людини вказують на те, що рупатадин метаболізується переважно цитохромом Р450 (CYP3A4). Особливі групи пацієнтів У ході дослідження за участю здорових добровольців для порівняння результатів, отриманих у молодих дорослих осіб та осіб літнього віку, величини AUC і Сmax рупатадину були вищими у осіб літнього віку у порівнянні з даними, отриманими у молодих дорослих осіб. Ймовірно, це обумовлено зниженням печінкового метаболізму при першому проходженні через печінку у осіб літнього віку. Щодо метаболітів відмінностей між показниками AUC і Сmax у молодих дорослих осіб та осіб літнього віку не спостерігалося. Середній період напіввиведення рупатадину у літніх і у молодих добровольців становив 8,7 години і 5,9 години відповідно. Оскільки результати для рупатадину і для його метаболітів не були клінічно значущими, був зроблений висновок, що при призначенні 10 мг лікарського засобу пацієнтам літнього віку корекція дози не потрібна. Доклінічні дані з безпеки Дані доклінічних досліджень не вказують на існування особливого ризику для людського організму на підставі стандартних досліджень фармакологічної токсичності при повторному застосуванні, генотоксичності та канцерогенності. Дози рупатадину, що у 100 разів перевищували рекомендовану клінічну дозу (10 мг), не впливали на інтервали QTc та QRS і не спричиняли симптомів аритмії у різних видів тварин, наприклад у щурів, морських свинок та собак. Рупатадин та його основний метаболіт в організмі людини, 3-гідроксидезлоратадин, не впливають на потенціал дії серцевого м'язу у волокнах Пуркіньє собак у концентраціях, що мінімум у 2000 разів вищі за максимальну концентрацію в плазмі людини при застосуванні 10 мг препарату. Під час дослідження впливу рупатадину на клонований ген специфічного калієвого каналу серця він пригнічував цей канал у концентрації, що була у 1685 разів вищою за максимальну концентрацію в плазмі, яка досягалася при застосуванні 10 мг препарату. Дезлоратадин, метаболіт із найвищою активністю, не чинить жодного впливу при концентрації 10 мкМоль/л. Дослідження розподілу в тканинах щурів радіоактивно міченого рупатадину показали, що він не накопичується в тканинах серця. Спостерігалося значне зниження фертильності як самців, так і самок щурів при застосуванні дози 120 мг/кг/добу, коли максимальна концентрація у 268 разів вища за Cmax в організмі людини, яка досягається при застосуванні терапевтичної дози (10 мг/добу). Повідомлялося про токсичний вплив на плід (затримка розвитку, неповне утворення кісткової речовини, незначні відхилення розвитку скелета) у щурів при токсичних для самок дозах (25 та 120 мг/кг/добу). Під час досліджень на кролях токсичний вплив на розвиток спостерігався при застосуванні доз до 100 мг/кг. Рівень, що не викликає шкідливої дії, для щурів становить 5 мг/кг/добу, а для кролів – 100 мг/кг/добу, при цьому Cmax відповідно у 45 та 116 разів вища за концентрацію, що досягається при застосуванні терапевтичної дози, у людини (10 мг/добу).
- Засоби, що діють на респіраторну систему. Інші антигістамінні препарати для системного застосування. Рупатадин. Код АТХ R06A X28.
- Взаємодія таблеток рупатадину по 10 мг із іншими лікарськими засобами досліджувалась у дорослих та дітей віком від 12 років. Вплив інших лікарських засобів на дію рупатадину Слід уникати супутнього застосування потужних інгібіторів CYP3A4 (наприклад ітраконазолу, кетоконазолу, вориконазолу, позаконазолу, інгібіторів ВІЛ протеази, кларитроміцину, нефазодону), а помірні інгібітори CYP3A4 (еритроміцин, флуконазол, дилтіазем) потрібно застосовувати з особливою обережністю. Сумісне призначення рупатадину у дозі 20 мг і кетоконазолу або еритроміцину підсилює системну дію рупатадину в 10 разів і в 2–3 рази відповідно. Ці модифікації не супроводжуються змінами інтервалу QT або збільшенням побічних реакцій порівняно з окремим застосуванням вказаних препаратів. Взаємодія з грейпфрутом Одночасний прийом грейпфрутового соку в 3,5 раза підсилює загальну дію рупатадину. Не слід вживати грейпфрутовий сік одночасно з прийомом препарату. Вплив рупатадину на інші лікарські засоби Слід з обережністю застосовувати рупатадин із іншими препаратами з вузьким терапевтичним діапазоном, оскільки інформація про його вплив на ці препарати обмежена. Взаємодія з алкоголем Після прийому алкоголю доза рупатадину 10 мг виявляє незначний вплив на результати деяких тестів на психомоторну активність, що значно не відрізняється від впливу прийому тільки одного алкоголю. Доза 20 мг підсилювала зміни, спричинені прийомом алкоголю. Взаємодія з депресантами ЦНС Як і у разі застосування інших антигістамінних препаратів, не можна виключити взаємодії з депресантами ЦНС. Взаємодія зі статинами Безсимптомне підвищення креатинфосфокінази іноді відмічали під час клінічних досліджень рупатадину. Ризик при взаємодії зі статинами, деякі з них також метаболізуються ізоферментом CYP3A4 цитохрому P450, невідомий. Тому рупатадин слід з обережністю застосовувати при одночасному призначенні зі статинами. Взаємодія з мідазоламом Після прийому дози рупатадину 10 мг у комбінації з 7,5 мг мідазоламом, підвищення експозиції (Cmax та AUC) мідазоламу була дещо вищою. З цієї причини рупатадин діє як легкий інгібітор CYP3A4.
- діюча речовина: рупатадину фумарат; 1 таблетка містить рупатадину фумарату 12,8 мг, що відповідає 10 мг рупатадину; допоміжні речовини: лактоза, моногідрат; крохмаль кукурудзяний прежелатинізований; целюлоза мікрокристалічна; заліза оксид червоний (Е 172); заліза оксид жовтий (Е 172); магнію стеарат.
- Вплив рупатадину 10 мг на здатність керувати транспортними засобами та працювати з іншими механізмами незначний. Проте слід бути обережним під час керування транспортними засобами та роботи з механізмами, допоки реакція організму на рупатадин не визначена.
- Вагітність Існують обмежені дані щодо застосування рупатадину вагітними жінкам. Дослідження на тваринах не свідчать про безпосередній або опосередкований шкідливий вплив на ембріон/плід, пери- та постнатальний розвиток (див. розділ «Фармакологічні властивості»). Як застережний захід слід уникати прийому рупатадину під час вагітності. Годування груддю Рупатадин виділяється в молоко тварин. Невідомо, чи проникає рупатадин з організму матері, яка годує груддю, у молоко. Потрібно прийняти рішення щодо припинення годування груддю або припинення/відмови від застосування рупатадину із урахуванням користі від грудного вигодовування для дитини та користі від терапії для жінки. Фертильність Клінічні дані про вплив на фертильність відсутні. Дослідження на тваринах свідчать про значне зниження фертильності при концентраціях, вищих за максимальні терапевтичні концентрації у людини (див. розділ «Фармакологічні властивості»).
- З 12 років
- Симптоматичне лікування алергічного риніту і кропив’янки у дорослих та підлітків віком від 12 років.
- Гіперчутливість до діючої речовини або до будь-якого іншого компонента препарату.
- Дорослі і діти віком від 12 років Рекомендована доза – 10 мг (одна таблетка) один раз на добу незалежно від прийому їжі. Пацієнти літнього віку Пацієнтам літнього віку рупатадин слід застосовувати з обережністю (див. розділ «Особливості застосування»). Пацієнти з нирковою або печінковою недостатністю Через відсутність клінічного досвіду застосування препарату пацієнтам з порушеннями функції нирок або печінки для лікування таких пацієнтів препарат не рекомендований. Тривалість лікування визначає лікар залежно від тяжкості та перебігу захворювання. Лікування слід припинити після зникнення симптомів та відновити після повторного їх виникнення.
- Під час клінічних досліджень рупатадин, таблетки по 10 мг, застосовувався в лікуванні 2043 дорослих та підлітків, 120 із яких приймали препарат мінімум протягом року. Найпоширенішими побічними реакціями під час контрольованих клінічних досліджень були сонливість (9,4 %), головний біль (6,9 %) і втома (3,1 %), астенія (1,5 %), сухість у роті (1,2 %), запаморочення (1,03 %). Більшість побічних явищ, що спостерігалися під час контрольованих клінічних досліджень, були від слабкого до помірного ступеня і зазвичай не вимагали припинення лікування. Частота небажаних реакцій визначена таким чином: часто (≥ 1/100 до < 1/10); нечасто (≥ 1/1000 до < 1/100); рідко (≥1/10000 до <1/1000). Повідомлялося про нижчезазначені небажані реакції у пацієнтів під час застосування препарату у ході клінічних досліджень та під час післяреєстраційного застосування. Інфекції та інвазії Нечасто: фарингіт, риніт. З боку імунної системи Рідко: реакції гіперчутливості (у тому числі анафілактичні реакції, ангіоневротичний набряк та кропив’янка)*. З боку метаболізму і харчування Нечасто: підвищення апетиту. З боку нервової системи Часто: сонливість, головний біль, запаморочення. Нечасто: порушення уваги. З боку серця Рідко: тахікардія та часте серцебиття*. З боку дихальної системи Нечасто: носова кровотеча, сухість слизової оболонки носа, кашель, сухість у горлі, болі в глотці і в гортані. З боку травної системи Часто: сухість у роті. Нечасто: нудота, біль у верхній частині живота, діарея, диспепсія, блювання, біль у животі, запор. З боку шкіри і підшкірної тканини Нечасто: висип. З боку скелетно-м’язової і сполучної тканини Нечасто: біль у спині, артралгія, міалгія. Загальні порушення Часто: втома, астенія. Нечасто: спрага, нездужання, гарячка, подразнення. Порушення, виявлені в результаті лабораторних досліджень Нечасто: підвищення креатинфосфокінази крові, підвищення аланінамінотрансферази, підвищення аспартатамінотрансферази, патологічні функціональні печінкові проби, збільшення маси тіла. *Повідомлялося про три рідкі випадки тахікардії, частого серцебиття та реакцій гіперчутливості (у тому числі анафілактичні реакції, ангіоневротичний набряк та кропив’янка) під час післяреєстраційного застосування рупатадину в лікарській формі таблеток по 10 мг. Повідомлення про підозрювані побічні реакції Повідомлення про побічні реакції після реєстрації лікарського засобу має важливе значення. Це дає змогу проводити моніторинг співвідношення користь/ризик при застосуванні цього лікарського засобу. Медичним та фармацевтичним працівникам, а також пацієнтам або їх законним представникам слід повідомляти про усі випадки підозрюваних побічних реакцій та відсутності ефективності лікарського засобу через Автоматизовану інформаційну систему з фармаконагляду за посиланням: https://aisf.dec.gov.ua».
- Не повідомлялося про випадки передозування препаратом. У ході дослідження клінічної безпеки рупатадин добре переносився в добовій дозі 100 мг протягом 6 днів. Найпоширенішою побічною реакцією є сонливість. При випадковому прийомі всередину дуже високих доз рекомендована симптоматична та підтримуюча терапія.
- Зберігати в картонній коробці для захисту від світла. Зберігати у недоступному для дітей місці.
Часті запитання
- Ціна на препарат Рупафін таблетки по 10 мг, 30 шт. в Україні від 410.9 до 531.9
- Діючі речовини у Рупафін таблетки по 10 мг, 30 шт. є рупатадину фумарат
- Рупафін таблетки по 10 мг, 30 шт. є рецептурним препаратом, та відпускається тільки з рецептом від лікаря
- Рупафін таблетки по 10 мг, 30 шт. заборонено приймати вагітним
- Рупафін таблетки по 10 мг, 30 шт. з обережністю приймати під час грудного вигодовування
- Рупафін таблетки по 10 мг, 30 шт. з обережністю приймати алергетикам
- Рупафін таблетки по 10 мг, 30 шт. дозволено приймати діабетикам
- Рекомендована температура для зберігання Рупафін таблетки по 10 мг, 30 шт. від 5 °С до 25 °С
- Рекомендований термін зберігання Рупафін таблетки по 10 мг, 30 шт. 3 роки
Відгуки про товар
Ще немає відгуків про товар.Будь першим, хто залишить відгук.